Функциональная гипоталамическая аменорея – мультидисциплинарный подход к диагностике и терапии
Резюме
Функциональная гипоталамическая аменорея (ФГА) определяется как потенциально обратимое неорганическое расстройство, характеризующееся низким уровнем эстрадиола, ановуляцией и отсутствием менструаций, при котором нарушение пульсирующей секреции гонадотропин-рилизинг-гормона (ГнРГ) играет ключевую роль. В данном обзоре литературы представлена актуальная информация о ФГА как о междисциплинарном заболевании. ФГА является диагнозом исключения и развивается в результате действия на организм чрезмерного стресса, низкой массы тела, избыточной физической активности, причем понятие чрезмерности действия этих факторов является весьма индивидуальным в каждом конкретном случае. Отражены краткосрочные и долгосрочные изменения в системах организма, которые являются мишенями действия эстрадиола в условиях развивающейся ФГА. Особое внимание уделено вопросам патогенеза, дифференциальной диагностики и лечения, включая такие средства как когнитивная поведенческая терапия, коррекция образа жизни, применение биологически активных микронутриентов, гормональная терапия.
Ключевые слова: функциональная гипоталамическая аменорея, стресс, эстрогены, остеопороз, когнитивно-поведенческая терапия, гормональная терапия, биологические активные пищевые добавки.
ВВЕДЕНИЕ
Менструальный цикл является одним из витальных признаков общего состояния здоровья женщины. Точно так же, как артериальное давление, частота сердечных сокращений или частота дыхания, которые могут быть ключом к диагностике потенциально серьезных заболеваний, оценка аномальных менструальных паттернов может облегчить раннее выявление потенциальных проблем со здоровьем [1].
Первичная аменорея определяется как отсутствие менархе к 15–16 годам при наличии развития молочной железы или через три года после телархе; отсутствие телархе к 13–14 годам является критерием диагностики задержки полового развития [2]. Вторичная аменорея является состоянием, при котором менструации отсутствуют в течение более трех месяцев при наличии ранее регулярного менструального цикла или более шести месяцев у пациенток с ранее нерегулярным циклом [3].
Функциональная гипоталамическая аменорея (ФГА) - распространенная форма хронического ановуляторного расстройства, связанного с гипогонадотропным гипогонадизмом. По данным Американского общества репродуктивной медицины, ФГА является причиной 20–35 % случаев вторичной аменореи и примерно 3 % случаев первичной аменореи [4].
Будучи обратимым, это состояние этиологически обусловлено психологическим стрессом, чрезмерной физической нагрузкой, недостаточным питанием или сочетанием перечисленных факторов, которые приводят к подавлению гипоталамо-гипофизарно-яичниковой оси и влекут за собой метаболические нарушения, включая потерю костной массы, и снижение фертильности [5–10]. Часто единственной жалобой таких пациенток бывает отсутствие менструаций, их не беспокоят симптомы, обусловленные низким уровнем эстрадиола, и они не знают о последствиях его дефицита.
Ограниченное питание и интенсивные физические упражнения являются независимыми факторами риска развития ФГА, и они часто наблюдаются одновременно, с формально установленным диагнозом расстройства пищевого поведения или без него. Сочетание расстройств пищевого поведения, аменореи и снижения костной плотности на фоне высоких физических нагрузок описывается как «триада спортсменок» [5, 9].
Это понятие, которое также иногда обозначается как «женская атлетическая триада», подразумевает под собой взаимодействие между доступностью энергии, менструальным циклом и плотностью костной ткани: женщины, которые часто и/или избыточно тренируются, как правило, имеют относительный дефицит калорий, нарушение ритма менструаций или ФГА, а также снижение минеральной плотности кости (МПК), что делает их более склонными к переломам, особенно стрессовым. Важно отметить, что женщины с «триадой спортсменок» могут иметь низкий или нормальный вес, но те, у которых масса тела составляет менее 85 % от идеальной, примерно в четыре раза чаще имеют менструальную дисфункцию и низкую МПК [11].
Вне зависимости от сочетанного или изолированного действия стрессовых факторов в генезе ФГА, возникающий в результате нейроэндокринной дисфункции эстрогенный дефицит негативно влияет на женское здоровье. Это особенно отчетливо проявляется при длительной аменорее, которая ассоциируется с неблагоприятными последствиями для костной, сердечно-сосудистой, нервной и репродуктивной систем, а также метаболизма в целом [12].
ГЕНЕТИЧЕСКАЯ СОСТАВЛЯЮЩАЯ ФУНКЦИОНАЛЬНОЙ ГИПОТАЛАМИЧЕСКОЙ АМЕНОРЕИ
У пациенток с ФГА отмечены мутации в генах, регулирующих действие гонадотропин-рилизинг-гормона (ГнРГ) и нейронов гипоталамуса, которые его вырабатывают (ГнРГ-нейроны). Было отмечено, что полиформизмы генов, обнаруженные у пациенток с идиопатическим гипогонадотропным гипогонадизмом (ИГГ), также свойственны пациенткам с ФГА. ИГГ традиционно считался генетически детерминированной, врожденной и пожизненной формой дефицита ГнРГ. Однако у части пациенток с ИГГ (около 10 %) отмечается восстановление менструального цикла после прекращения лечения, даже если у них есть генетические дефекты. Данный факт указывает на пластичность функциональной сети ГнРГ и ее чувствительность к негенетическим факторам [13].
Гетерозиготные мутации в генах, ассоциированных с идиопатическим гипогонадотропным гипогонадизмом (FGFR1, PROKR2, GNRHR и KAL1), были выявлены у 7 из 55 пациенток с ФГА; при этом мутации в генах PROKR2 и GNRHR были выявлены также у 8 из 160 пациенток с ИГГ, в то время как в контрольных группах, включавших менструирующих женщин без факторов риска и имеющих интенсивные физические нагрузки, мутаций в этих генах выявлено не было (Табл. 1) [14].
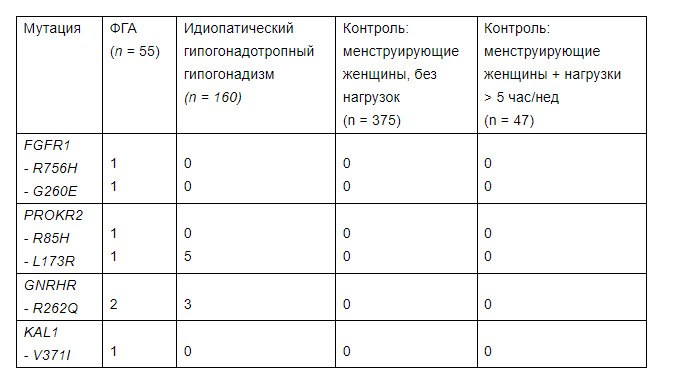
Таблица 1. Частота выявления мутаций генов, ответственных за продукцию гонадотропинов у женщин с ФГА [14].
Особенности онтогенеза ГнРГ-нейронов позволили дифференцировать гены в две группы: «нейроформирующие» гены, отвечающие за нормальные развитие и миграцию нейронов, и «нейроэндокринные» гены, влияющие на выработку ГнРГ и его биологические эффекты. В отношении ФГА больший интерес представляют нейроформирующие (FGFR1, PROKR2, KAL1), в меньшей степени нейроэндокринные (GNRHR) гены [15, 16].
Ген GNRHR кодирует уникальный рецептор, находящийся на гонадотрофах гипофиза и активируемый ГнРГ [17]. Благодаря адекватной работе этого рецептора запускается весь каскад действия ГнРГ, основным результатом которого является нормальный синтез и секреция гонадотропинов – фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ).
Продукты генов KAL1 и PROKR2 имеют решающее значение для миграции ГнРГ-нейронов [16]. Эти нейроны дифференцируются в эпителии медиальной обонятельной ямки, и затем мигрируют в место своего функционирования – гипоталамус [18]. Их миграция – многоступенчатый процесс, в ходе которого задействованы белки аносмин-1 (продукт гена KAL1) и рецептор прокинетицина-2 (продукт гена PROKR2). Рецептор 1 типа фактора роста фибробластов (продукт гена FGFR1) также выступает участником миграции ГнРГ-нейронов, одновременно контролируя их специфичность и выживание [19].
Исследование генетических детерминант гипогонадотропного гипогонадизма в большинстве случаев обусловлено научным интересом. Скрининг женщин с ФГА на наличие мутаций в локусах, лежащих в основе идиопатического гипогонадотропного гипогонадизма не рекомендован, за исключением случаев явного семейного наследования ФГА или идиопатического гипогонадотропного гипогонадизма.
НЕЙРОЭНДОКРИННЫЕ ФАКТОРЫ ФУНКЦИОНАЛЬНОЙ ГИПОТАЛАМИЧЕСКОЙ АМЕНОРЕИ
Среди многих нейропептидов и нейрогормонов, функционально модулирующих гипоталамические нейроны, в качестве потенциально главного игрока в регуляции ГнРГ, как физиологической, так и патологической, рассматривается кисспептин [20]. Основным местом секреции кисспептина является гипоталамус, а точнее аркуатное ядро и преоптическая область. Кисспептин имеет прямое активирующее влияние на синтез и высвобождение ГнРГ, зависимое от фазы менструального цикла [21]. У женщин с нормальным менструальным циклом была продемонстрирована специфическая временнáя связь между секреторными импульсами кисспептина и лютеинизирующего гормона (ЛГ), происходящими в одно и то же время [22].
Секреция кисспептина не только отражает состояние репродуктивной оси, но и может указывать на зависимость ее функций от других гипоталамо-гипофизарных осей: отрицательная корреляция между концентрацией и частотой пульса кисспептина и уровнем кортизола в плазме крови демонстрирует наличие связи между гипоталамо-гипофизарно-яичниковой (ГГЯ) и гипоталамо-гипофизарно-надпочечниковой (ГГН) осями [23]. У пациенток с ФГА определяется низкий интегральный уровень кисспептина при нормальной частоте его пульсов, а также повышенные уровни кортикотропин-рилизинг гормона (КРГ) и кортизола [24]. Концентрации ЛГ и кисспептина обратно коррелируют с уровнями кортизола. Эта отрицательная ассоциация подтверждает негативную роль гиперактивации ГГН-оси в отношении функций репродуктивной системы [6, 25].
Между метаболизмом, стрессом и репродукцией существуют тесные взаимосвязи, лучшим доказательством чего являются многочисленные положительные и отрицательные корреляции, обнаруженные между индексом массы тела (ИМТ), сывороточными концентрациями кортизола, инсулина, глюкозы, ЛГ и кисспептина.
Представляет интерес взаимосвязь между концентрациями в сыворотке крови инсулина и дегидроэпиандростерона сульфата (ДГЭАС). У пациенток с ФГА на фоне нормального уровня ЛГ (выше 3 МЕ/л) наблюдалась отрицательная корреляция сывороточного инсулина с ДГЭАС, что не было отмечено у пациенток с ФГА на фоне низкого уровня ЛГ. Данный феномен может быть объяснен тем, что эти категории пациенток с ФГА представляют собой два различных момента клинической эволюции патологического процесса [26]. Женщины с более высокими концентрациями ЛГ, вероятно, находятся на первых стадиях нарушения и стрессовая реакция у них не переходит грань условной адаптации. Напротив, пациентки с низкими уровнями ЛГ представляют собой группу, адаптивная реакция у которой уже нарушила нормальный биологический контроль репродукции.
Женщины с ФГА испытывают хронический энергетический дефицит и, согласно наблюдательным исследованиям, имеют низкие уровни лептина при отсутствии суточных колебаний его секреции [27, 28]. Это представляется весьма логичным в условиях недостатка ресурсов, т.к. известно, что лептин отражает количество запасов энергии в жировой ткани, а также острые изменения в потреблении энергии.
Голодание и потеря веса сопровождаются адаптивным снижением циркулирующих концентраций гормонов щитовидной железы и тиреоидсвязывающего глобулина (ТСГ) для уменьшения скорости основного обмена, при этом уровень тиреотропного гормона (ТТГ) у больных ФГА нормален или незначительно снижен, а реакция ТТГ на экзогенную стимуляцию притуплена и замедлена [29, 30].
Таким образом, ФГА предоставляет широкий спектр нейроэндокринных нарушений. Но с позиций клинической манифестации и долгосрочных рисков основную роль в этой палитре играет гипоэстрогенемия.
СОСТОЯНИЕ КОСТНОЙ ТКАНИ В УСЛОВИЯХ ГИПОЭСТРОГЕНЕМИИ
Подростковый период является основным временем накопления костной ткани. К 18 годам МПК девушки в норме достигает 92 % от пикового уровня, на который костная масса выходит к середине четвертой декады жизни. У женщин процессы роста и метаболизма кости прямо зависят от уровней эстрогенов, которые оказывают тройное действие, активируя звенья костного ремоделирования, стимулируя костеобразование и подавляя костную резорбцию.
Костная резорбция осуществляется остеокластами, активность которых модулируется различными механизмами, включая ингибирование продукции RANKL, повышение экспрессии гена остеопротегерина (OPG) и продукция цитокинов [31]. Эстрогены подавляют цитокины, способствующие резорбции костной ткани, такие как макрофагальный колониестимулирующий фактор, интерлейкины 1 и 6 (IL-1, IL-6), фактор некроза опухоли α (TNFα).
Одновременно эстрогены стимулируют экспрессию костного морфогенетического белка 6 (ВМР-6), трансформирующего фактора роста β (TGF-β), инсулиноподобного фактора роста 1 (IGF-1), локально продуцируемого в кости после стимуляции гормоном роста, продукция которого также усиливается эстрогенами. Под действием эстрогенов повышается экспрессия рецепторов витамина D, важного регулятора кальциевого гомеостаза и костного метаболизма [32]. Эстрогены также косвенно способствуют активности остеобластов, снижая уровень склеростина, ингибирующего сигнальный путь WNT (ключевой регулятор остеобластогенеза) [33] и преадипоцитарного фактора-1 (Pref-1) [34], члена семейства эпидермального фактора роста (EGF), который препятствует дифференцировке в остеобласты мезенхимных клеток-предшественников.
Снижение соотношения OPG/RANKL и повышение уровня склеростина было зарегистрировано у взрослых женщин с аменореей и нервной анорексией [35], причем длительность аменореи была прямо связана с ухудшением состояния скелета [36, 37], так же, как и наличие аменореи в анамнезе [38, 39]. Однако резорбция кости у взрослых женщин с аменореей и нервной анорексией выше, чем у женщин в постменопаузе, что позволяет предположить действие дополнительных факторов, способствующих усилению потери МПК [40, 41].
Поскольку утрата эстрогенных влияний у молодых женщин ведет к недостаточному накоплению МПК и провоцирует повышение риска переломов, оценка состояния костной ткани является одной из важных задач в рамках наблюдения пациенток с ФГА. Для выполнения денситометрии у данного контингента больных существуют следующие показания [5, 42]: длительность аменореи более 6 месяцев, тяжелый дефицит питания, история перелома в результате травмы.
Двухэнергетическая рентгеновская абсорбциометрия (денситометрия) дает оценку МПК с помощью Z и T критериев. Z-критерий сравнивает МПК с костной плотностью у субъектов аналогичного пола и возраста, поэтому женщин в пременопаузе, особенно у подростков, имеет гораздо большее значение. Снижение МПК регистрируется при значении Z-критерием от -1,0 до -1,9 имеют низкую плотность костной ткани. Термин низкая плотность костной ткани предпочтительнее, чем остеопения в молодой популяции. Остеопороз определяется как показатель Z, ниже, чем -2. Распространенность низкой МПК у женщин с ФГА может увеличиваться до 62 % при накоплении факторов риска, таких как позднее менархе и дефицит массы тела [43].
НЕРВНАЯ СИСТЕМА В УСЛОВИЯХ ГИПОЭСТРОГЕНЕМИИ
Эстрадиол играет важную роль в поддержании архитектоники головного мозга и его метаболизма, поэтому длительное сохранение низких уровней гормона может негативно повлиять на состояние нервной системы. Помимо этого, вызванное стрессом повышение кортизола в цереброспинальной жидкости обладает прямой нейрональной и глиальной токсичностью и потенцирует ранний апоптоз в уязвимых областях мозга [44]. Нарушения нейрогенеза и синаптических связей могут быть также вызваны изменениями в оси «гипофиз – щитовидная железа» у женщин с ФГА. Наконец, длительный дистресс и сопутствующие ему гормональные эффекты модулируют обмен веществ в сторону катаболизма, что может сделать человека более восприимчивым к последующим стрессорам, включая, например, инфекции.
С другой стороны, снижение уровня стрессовой реакции не только восстанавливает фертильность, но также уменьшает нейровоспаление, защищает от преждевременного старения мозга и, возможно, от нейродегенеративных заболеваний [45]. Более того, балансирование стрессового ответа при снижении уровней глюкокортикоидов позволяет осуществить нейропоротективное действие и даже выйти за его рамки с достижением, в конечном итоге, нейропревенции [46].
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА В УСЛОВИЯХ ГИПОЭСТРОГЕНЕМИИ
Исследование WISE (Women’s Ischemia Syndrome Evaluation) показало, что ФГА может быть связана с неблагоприятными сердечно-сосудистыми последствиями [47]. Пациентки с ангиографическими признаками коронарной болезни сердца с большей вероятностью имели сывороточный уровень эстрадиола менее 50 пг/мл и низкие уровни гонадотропинов (ЛГ <10 МЕ/л и ФСГ <10 МЕ/л) по сравнению с женщинами с нормальными коронарными сосудами. По этой причине ФГА считается независимым фактором риска ишемической болезни сердца и сохраняет свою значимость даже после корректировки по другим вероятным предикторам [47].
Несмотря на фактический пременопаузальный статус и регулярные аэробные физические нагрузки, у молодых женщин с ФГА обнаруживаются эндотелиальная дисфункция, повышение уровней общего холестерина и липопротеинов низкой плотности (ЛПНП), а также признаки окислительного стресса [48]. Эндотелиальная функция нарушена отчасти из-за повышенного сосудистого тонуса и низкой скорости сдвига (градиент скорости, характеризующий быстроту ее изменения при переходе от слоя к слою), а также неадекватной чувствительности сосудистых эндотелиоцитов и миоцитов к оксиду азота [48]. Эти наблюдения отражают фенотип, сходный с сердечно-сосудистым профилем женщин после естественной или хирургической менопаузы.
Таким образом, гипоэстрогенемия может нивелировать известные сосудистые преимущества как регулярных физических упражнений, так и пременопаузального статуса. Положительные результаты применения аэробных тренировок и умеренного ограничения калорий в общей популяции нельзя экстраполировать на пациенток с ФГА точно так же, как нельзя применять к популяции молодых женщин с гипоэстрогенемией принципы здорового образа жизни в периоде постменопаузы.
АЛГОРИТМ ДИАГНОСТИКИ ФУНКЦИОНАЛЬНОЙ ГИПОТАЛАМИЧЕСКОЙ АМЕНОРЕИ
Диагноз ФГА ставится методом последовательного исключения других причин аменореи. В первую очередь следует отвергнуть физиологическую причину отсутствия менструаций – беременность. Одним из главных паттернов в диагностике является грамотный сбор анамнеза, включающий историю внутриматочных вмешательств при синдроме Ашермана, анамнез операций на яичниках, хмимиотерапии и лучевой терапии злокачественных новообразований, наличия вазомоторных симптомов при преждевременной недостаточности яичников.
Вопросы для оценки полей зрения и уточнение функции обоняния позволяют заподозрить вероятную аденому гипофиза и синдрома Каллмана. Анамнез приема лекарственных средств очень важен, так как, например, антипсихотичекие медикаменты являются одной из распространенных причин гиперпролактинемии, приводящей к аменорее. Использование гормональной контрацепции, противоэпилептических лекарств, употребление психоактивных средств также могут быть связаны с нарушениями менструального цикла.
Данные о соблюдении строгой диеты, интенсивных физических нагрузках, потере веса и нервной анорексии, собранные надлежащим образом при изучении истории пациентки, позволяют предположить причину аменореи. Необходимо обращать внимание на наличие в анамнезе соматических заболеваний, в том числе гранулематозных (например, нейросаркоидоз), болезней накопления (гемохроматоз) и патологии, связанной с недостаточным поступлением энергетических ресурсов из-за мальабсорбции или гипоксии, по причине значимого влияния данных факторов на гипоталамо-гипофизарно-яичниковую ось [49].
ФГА – это диагноз, для установления которого должны быть последовательно исключены другие формы гипогонадизма и структурные аномалии генитального тракта. Диагностика состояний, связанных с нарушением оттока менструальной крови, обычно не представляет затруднений при условиях тщательного сбора анамнеза, обязательного проведения гинекологического осмотра и выполнении ультразвукового исследования (УЗИ), а при необходимости уточнения данных – магниторезонансной томографии (МРТ) [50]. Дифференциальный поиск среди причин гипогонадизма требует от клинициста достаточно большого объема знаний в области гинекологии и эндокринологии.
Диагностика эндокринной причины аменореи начинается с оценки гормонального профиля крови, который должен включать определение уровней гонадотропинов, пролактина, ТТГ и гонадотропинов; спектр исследований может быть расширен определением концентраций эстрадиола и антимюллерова гормона. Для ФГА характерны сниженные или низкие нормальные уровни ЛГ и ФСГ (<5 МЕ/л) при соотношении ЛГ/ФСГ <1 и низкая концентрация сывороточного эстрадиола [5]. Присутствие признаков гиперандрогенизма расширяет объем тестирования, включая в него тестостерон, ДГЭАС, а также 17-гидроксипрогестерона при необходимости исключения неклассической врожденной дисфункции коры надпочечников.
Вопрос о проведении МРТ решается в зависимости от результатов гормональных исследований и клинических данных. Подозрение на опухоль у пациенток с высокими значениями гипофизарных гормонов, неврологическая симптоматика и другие данные, позволяющие предположить новообразование головного мозга, требуют направления на МРТ области гипофиза и/или головного мозга в условиях контрастирования.
ДИАГНОСТИЧЕСКАЯ ГОЛОВОЛОМКА: СИНДРОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ ИЛИ ФУНКЦИОНАЛЬНАЯ ГИПОТАЛАМИЧЕСКАЯ АМЕНОРЕЯ?
Главным патофизиологическим различием между двумя «диагнозами исключения» – синдромом поликистозных яичников (СПКЯ) и ФГА является изменение пульсации ГнРГ, которая увеличивается при СПКЯ и уменьшается при ФГА. Однако если женщина с фенотипом СПКЯ, особенно в молодом возрасте, переживает стрессовую нагрузку, связанную с энергетическим дефицитом, у нее начинает формироваться ФГА, и частота пульса ГнРГ, а затем и уровень ЛГ снижаются. В результате может временно исчезнуть важный отличительный признак СПКЯ – соотношение ЛГ/ФСГ >1. Но при этом следует учитывать, что уровень ЛГ только отчасти определяет увеличение андрогенного биосинтеза в яичниках, который при СПКЯ в большей степени зависит от генетически обусловленных изменений овариальной чувствительности к сигналам ЛГ. В результате секреция тестостерона сохраняется, в отличие от ситуации с ФГА, для которой характерно существенное снижение уровней гормона.
Женщины с нарушениями менструального цикла, у которых СПКЯ и ФГА являются наиболее вероятными диагнозами, создают для клинициста диагностическую головоломку [51]. Одной из особенностей СПКЯ является поликистозная морфология яичников (ПКМЯ), которая обнаруживается при выполнении УЗИ у 80–88 % больных, но тот же овариальный фенотип встречается и у пациенток с ФГА (30–45 %) [51]. При вариабельности гормонального профиля даже опытный клиницист может столкнуться с диагностической неопределенностью у женщин, страдающих аменореей, и, как итог, неправильным выбором лечебной тактики. Возможное сосуществование заболеваний еще больше усложняет диагностику и расширяет панель исследований, включая в нее различные клинические, биохимические и рентгенологические параметры. В том числе женщинам с фенотипом СПКЯ и возникшей на этом фоне ФГА рекомендуется денситометрия с целью определения МПК при условии длительной аменореи (6 месяцев и более) или подозрении на тяжелую недостаточность питания в процессе соблюдения ограничительных диет [5].
ЛЕЧЕНИЕ ФУНКЦИОНАЛЬНОЙ ГИПОТАЛАМИЧЕСКОЙ АМЕНОРЕИ
Патогенетическая терапия ФГА должна быть направлена на повышение влияний кисспептина и нейрокинина соответствующими агонистами, и подавление динорфина его антагонистами. Терапевтическую роль антагонистов динорфина, таких как налоксон, у пациентов с аномально низкой секрецией ЛГ еще предстоит выяснить. Экзогенный кисспептин уже имеет свою нишу применения в практике лечения женщин с гипоталамической аменореей любого происхождения [52], включая гипогонадотропный гипогонадизм, вторичный по отношению к мутациям нейрокинина В и/или его рецептора [53]. Но задача восстановления менструального цикла не является самоцелью. Главными направлениями лечебных мероприятий следует считать сохранение здоровья женщины и восстановление фертильности, когда в этом появляется потребность.
Поскольку ФГА часто провоцируется сочетанием факторов, включая чрезмерные физические нагрузки, недостаточное питание и психосоциальный дистресс, мультидисциплинарный терапевтический подход является наиболее правильным [5, 54]. Лечение должно устранить или скорректировать причину нарушения овуляторной функции путем зменения поведения, восстановления нормального питания и веса, снижения стрессовой нагрузки [5, 9, 54], для чего обычно требуются несколько специалистов, включая нутрициологов и психологов. В большинстве случаев приемлемо амбулаторное ведение, госпитализация нужна пациентки с тяжелой брадикардией, гипотензией или электролитными нарушениями [5].
Даже небольшая прибавка в весе порядка 5–10 % от массы тела может улучшить показатели метаболизма [55], но достичь ее бывает непросто. При всей очевидности нужды в микронутриентной коррекции диеты, рекомендации ограничиваются предложением применения L-карнитина в случаях установленного диагноза ФГА в его классических проявлениях у пациенток с дефицитом массы тела [56]. Между тем, для прибавки в весе следует действовать не только на метаболизм, но также на психическую сферу, поскольку именно центральный компонент определяет и расстройства пищевого поведения, и стресс-зависимую овуляторную дисфункцию. То же самое можно отнести на счет переедания и сопутствующей аменореи.
Существует немало витаминов, минералов и растительных экстрактов, которые положительно влияют на обмен веществ и психическое состояние пациенток, определяя возможность спонтанного восстановления менструального цикла при функциональных нарушениях. Например магний, блокируя активность NMDA-рецепторов и увеличивая концентрацию субкомпонента рецептора NMDA (GluN2B) в префронтальной коре [57], повышает нейропластичность и нейрогенез [58]. Оральные соли магния применяются в виде монопрепаратов или в композиции с витамином В6, поскольку эффективная доза магния слишком велика для ее внедрения в многокомпонентные средства. Другие микронутриенты и даже макронутриенты, напротив, могут входить в витаминно-минеральные комплексы.
Примером такого макронутриента служит докозагексаеновая кислота (ДГК) – представитель омега-3 полиненасыщенных жирных кислот (ПНЖК). Уровни омега-3 ПНЖК отрицательно коррелируют с депрессивными симптомами [59], а их добавление к пище связано со снижением уровня депрессии [60]. Несмотря на неоднозначность результатов гетерогенных по дизайну и выборкам исследований эффективности добавления омега-3 ПНЖК в пищу [61], их положительное влияние на центральную нервную систему (ЦНС) поддерживается большинством авторов. С другой стороны, положительное влияние потребления рыбы на депрессивные расстройства может быть связано не только с ПНЖК, конкретно – с ДГК [62], но и с тирозином, присутствующим в высоких концентрациях у многих рыб [63]. Тирозин является предшественником дофамина, норадреналина и адреналина, а также компонентом тироксина и трийодтиронина, что определяет связь его дефицита с депрессией [63]. Следует отметить, что дисфункция щитовидной железы закономерно возникает при ФГА [29, 30], а гипотиреоз встречается у 30 % пациентов с депрессией. Эти факты подчеркивают необходимость дотации женщинам с ФГА йода. Следовательно, одним из вариантов назначения омега-3 ПНЖК для женской популяции может считаться Витажиналь® Мама, содержащий 200 мкг ДГК и 150 мкг йода совместно с витамином Е, фолиевой кислотой и витамином D.
Для нормального функционирования мозга необходим адекватный уровень витаминов группы В [64], которые в качестве катализирующих кофакторов влияют на когнитивные функции и настроение [65]. В ряде исследований указывается высокая распространенность фолатного дефицита среди пациентов, страдающих психическими расстройствами [64] и возможность использовать фолиевую кислоту для улучшения психического статуса.
Среди микроэлементов, важных для защиты от психических расстройств, обратим внимание на хром. Общеизвестная метаболическая роль хрома обеспечивает улучшение чувствительности к инсулину в гипоталамусе, что усиливает функцию последнего благодаря повышению захвата глюкозы – основного питательного субстрата для мозга. В результате в гипоталамусе увеличивается синтез серотонина, норадреналина и мелатонина [64]. Поэтому хром имеет смысл назначать не только с целью коррекции углеводного обмена и снижения массы тела, но также для улучшения функционирования гипоталамуса.
Особенно интересен хром в составе комплекса Витажиналь® Инозит, который помимо хрома содержит ещё мио-инозитол, эпигалокатехин-3-галлат (EGCG), витамин D и фолиевую кислоту. Мио-инозитол привычно рассматривается в контексте комплексной терапии СПКЯ, поскольку обеспечивает улучшение чувствительности тканей к инсулину. Механизм этого эффекта связан с поддержкой внутриклеточного образования вторичных мессенджеров инсулина: фосфо-мио-инозитола-3-фосфата и инозитолфосфатгликана [66]. Но как уже было сказано выше, при любой форме гипоталамической дисфункции повышение чувствительности головного мозга к действию инсулина положительно влияет на течение патологического процесса благодаря улучшению питания и нейрональных процессов в гипоталамусе.
С позиций терапии ФГА важно, что мио-инозитол регулирует продукцию и действие ТТГ и ФСГ, для которых фосфо-мио-инозитол-3-фосфат также является вторичным мессенджером [67]. Кроме того, эта молекула участвует в передаче сигнала рецепторов ацетилхолина, глутамата, гамма-аминомасляной кислоты (ГАМК). Обладая столь разносторонними возможностями, мио-инозитол обеспечивает взаимодействие нейрогормонов и нейротрансмиттеров, энергетический метаболизм в ЦНС, долговременное потенцирование в гиппокампе и защиту нейронов от окислительного стресса [68, 69]. Следует упомянуть, что сигналы рецептора кисспептина KISS1R передаются с посредничеством инозитол-монофосфата. Применение агониста кисспептина вызывало повышение уровней ЛГ, сходное у больных СПКЯ и здоровых женщин, но у пациенток с ФГА рост ЛГ был достоверно большим (р = 0,004) [70]. Дифференцированное влияние кисспептина на гормональный синтез через идентичные молекулярные механизмы, зависимые от мио-инозитола, позволяет расширить показания для назначения мио-инозитола и предлагать содержащие его комплексы больным ФГА.
В тех случаях, когда аменорея сохраняется на фоне негормонального лечения, назначается заместительная гормональная терапия (ЗГТ) с целью поддержания нормального уровня эстрадиола. Однако с инициацией гормональной терапии у больных ФГА затягивать нельзя. Стойкая гипоэстрогенемия приводит к дисфункции эстрогеновых рецепторов и измененному ответу на введение экзогенных гормонов [71], и при длительном дефиците эстрогенов изменения в ЦНС могут стать необратимыми. Большинство исследователей придерживаются позиции, что ЗГТ повторными короткими курсами по 3–6 месяцев должна проводиться пациенткам, длительность аменореи у которых превысила 6 месяцев.
Для женщин, не нуждающихся в контрацепции, целесообразно использование препаратов эстрадиола и прогестагена в циклическом режиме. Применение данной схемы, сходной с таковой в периоде менопаузального перехода, способствует накоплению костной ткани и не препятствует спонтанному восстановлению овуляции. Трансдермальные эстрогены (ТДЭ) предпочтительнее пероральных из-за избегания первичного печеночного пассажа. При оральном приеме эстрадиол метаболизируется в печени, что снижает выработку IGF-1, уровни которого исходно редуцированы у пациенток с низким весом. По этой причине пероральные эстрогены не эффективны в увеличении МПК у женщин с аменореей и дефицитом массы тела в пременопаузе. Использование ТДЭ (Эстрожель®) позволяет избежать дополнительного подавления IGF-1 и уменьшения его трофического эффекта на ткань при сохранении благотворных эффектов эстрогена по увеличению МПК позвоночника и проксимального отдела бедра у молодых пациенток с низкой массой тела и аменореей на фоне нервной анорексии [72]. Интересные данные были получены при сравнении результатов применения ТДЭ как монотерапии и в сочетании с препаратом IGF-1 [73]. Через 12 месяцев лечения МПК поясничного отдела позвоночника достоверно увеличилась в группе монотерапии ТДЭ по сравнению с группой, получавшей комбинированную терапию (р = 0,004) при сравнимом результате по другим показателям. Уровни маркеров костной резорбции снижались в группе монотерапии (р = 0,042), тогда как в группе сочетанной терапии отмечалось повышение паратиреоидного гормона (р = 0,019) [73].
Выбор прогестагена не менее важен, и в контексте ФГА пероральный прием микронизированного прогестерона представляется наиболее предпочтительным. Как уже было отмечено, у пациенток с ФГА гиперкортизолемия оказывает прямой токсический эффект на нейроны и глию [44], что особенно опасно в условиях низких уровней эстрогенов и прогестерона, обеспечивающих защиту нервной ткани.
В головном мозге обнаружены рецепторы половых гормонов, которые, будучи мелкими жирорастворимыми молекулами, свободно проникают через гематоэнцефалический барьер (ГЭБ) [74]. В нервных клетках они подвергаются метаболизму с образованием так называемых нейростероидов; более того, в нейронах и глии коры головного мозга, гиппокампа и миндалины идет независимый синтез прогестерона [75]. Стероилы и нейростероиды абсолютно необходимы как для «настройки» функций ЦНС путем влияния на высвобождение, захват и метаболизм нейромедиаторов, так и для защиты структур головного мозга посредством поддержки митохондиальной активности в нейронах, увеличения мозгового кровотока, повышения транспорта глюкозы через ГЭБ и прямого нейропротективного и репаративного эффектов.
Среди нейроактивных прогестагенов заслуживают внимания две молекулы – прогестерон и его метаболит 3α,5α-тригидропрогестерон (THPROG), или аллопрегнананол [76]. На экспериментальных моделях нейродегенеративных заболеваний были показаны эффекты аллопрегнанолона по усилению нейрогенеза, улучшению когнитивных и моторных функций, снижению нейровоспаления и накопления бета-амилоида [77, 78]. Прогестерон повышает плотность зрелых олигодендритов, снижает плотность активированных астроцитов и микроглии, обеспечивает противовоспалительные эффекты [79]. Эффективность прогестерона и аллопрегнанолона была показана на экспериментальной модели аутоиммунного энцефалита, где данные стероиды обнаруживали промиелинизирующие, нейропротективные и противовоспалительные эффекты [80].
Прогестерон и аллопрегнанолон связаны с адаптацией к стрессу, увеличение производства прогестерона в головном мозге может быть частью реакции нервных клеток на повреждение, что обусловлено защитными и трофическими эффектами прогестерона [76]. Аллопрегнанолон в свою очередь способен защищать от стресс-зависимых нарушений через влияние на стресс-лимитирующие системы. К основным центральным стресс-лимитирующим системам относятся ГАМК-ергические и опиоидергические нейроны, реагирующие на молекулы, которые выделяются в процессе стрессовой реакции и уменьшающие ее выраженность, включая активность ГГН-оси. В условиях недостаточного контроля стрессовой реакции формируется дистресс, связанный с персистенцией глюкокортикоидов, которая приводит к негативным нейробиологическим эффектам, включая глутаматергическую гиперактивность, редукцию нейротрофического фактора, ослабление нейрогенеза, снижение нейропластичности с последующими дистрофическими процессами в аффективных структурах, особенно гиппокампе, миндалине и префронтальной коре.
Аллопрегнанолон выступает в качестве мощного положительного модулятора рецепторов ГАМК прямо связываясь с ними [81] или опосредуя свой эффект через G-протеин ассоциированные мембранные PR (GPPR), которые экспрессированы в клетках лимбической системы, полосатого тела, черной субстанции и мозжечка [82]. Повышая активность ГАМК-нейронов, прогестерон и аллопрегнанолон демонстрируют антидепрессивные и противотревожные эффекты [83]. Применение микронизированного прогестерона приводит к значительному повышению уровня аллопрегненалона, что сопровождается существенной редукцией кортизола и улучшением клинических характеристик стрессового ответа [84]. Таким образом, включение микронизированного прогестерона (Утрожестан®) в схемы гормональной терапии ФГА более чем оправдано.
Женщины с ФГА, нуждающиеся в предохранении от беременности, могут использовать комбинированные оральные контрацептивы (КОК). Но пациенток следует информировать о том, что КОК маскируют возвращение спонтанных менструаций и что потеря костной массы продолжится, если пациентки будут недополучать энергетические ресурсы [51].
Известно, что у пациенток с длительной аменореей повышается риск остеопороза [8], в терапии которого широко используются бисфосфонаты – средства антирезорбтивной терапии [85]. Однако, бисфосфонаты обладают тератогенным действием и из-за длительного периода полувыведения остаются в костной ткани в течение многих лет. Вследствие этого они не рекомендуются женщинам с нереализованным репродуктивным потенциалом, а негативное влияние на рост скелета ограничивают их применение у подростков [86]. Таким образом, профиль пользы/риска терапии бисфосфонатами у молодых женщин с ФГА в большинстве случаев не предполагает возможности их назначения [87].
Восстановление фертильности у женщин с ФГА, желающих реализовать свою репродуктивную функцию, проводится после возвращения нормальной массы тела. Стимуляция яичников рекомендуется при уровне ИМТ 18,5 кг/м2 или выше, поскольку дефицит веса существенно увеличивает риск неблагоприятных исходов беременности, включая самопроизвольный выкидыш, преждевременные роды и рождение маловесных детей [88].
В программах восстановления фертильности у больных ФГА используются гонадолиберин в пульсирующем режиме [89] или гонадототропины [90]. В качестве триггера овуляции, помимо известных схем введения хорионического гонадотропина человека (ХГЧ) или агониста ГнРГ, рассматривается возможность использования кисспептина [91], преимущества которого состоят в более физиологичном характере секреции гонадотропинов и снижении риска гиперстимуляции яичников.
Учитывая доказанное участие лептина в репродукции и низкие уровни гормона у пациенток с ФГА по сравнению со здоровыми женщинами, выглядит привлекательной идея применения лептина с целью терапии бесплодия. Однако, результаты проведенных в этой области исследований неоднозначны и на их основании рекомендовать внедрение лептина в клиническую практику среди больных ФГА преждевременно [92]. В целом, несмотря на потенциальное положительное влияние терапии ФГА рекомбинантным лептином, для нее существуют серьезные ограничения ввиду вероятности подавления аппетита, потери веса и снижения запаса жировой ткани. Эти эффекты вызывают особую озабоченность в случае наблюдения пациентов, которые заведомо находятся в состоянии дефицита энергетических ресурсов.
Прежде чем рекомендовать рекомбинантный лептин для терапии ФГА, необходимо определить дозу, состав и схему введения, которые могут позитивно влиять на репродуктивную функцию без индукции анорексигенных эффектов. Потребление пищи должно тщательно контролироваться, чтобы предотвратить потерю веса. В заключение следует отметить, что лептин никогда не заменит диетические и поведенческие рекомендации, которые в настоящее время являются предпочтительным методом лечения ФГА. Несомненно, экспериментальная терапия лептином женщин с ФГА позволила понять важную роль гормона в передаче сигналов о достаточных запасах энергии в ЦНС. Но, прежде чем рассматривать лептин даже в качестве адъювантного лечения, необходимо выполнить дополнительные исследования, особенно в отношении влияния гормона на костную ткань и массу тела.
КОГНИТИВНАЯ ПОВЕДЕНЧЕСКАЯ ТЕРАПИЯ В ЛЕЧЕНИИ ФУНКЦИОНАЛЬНОЙ ГИПОТАЛАМИЧЕСКОЙ АМЕНОРЕИ
Синергизм психологических и метаболических стрессоров предполагает возможность их одновременной коррекции у больных ФГА [93]. Для осуществления этой цели более всего подходит когнитивно-поведенческая терапия (КПТ), которая не только снижает влияние психосоциального дистресса на организм, но и способна устранить метаболический дисбаланс. Преимущества КПТ заключаются в длительном улучшении нейрохимических стрессовых реакций и противодействии будущим стрессовым нагрузкам благодаря повышению потенциала адаптации [94].
Рандомизированное исследование [94] показало, что КПТ не изменяет ИМТ, но повышает уровень лептина, корректирует гиперкортизолемию и стимулирует частичное восстановление функции щитовидной железы, хотя уровни Т3 и Т4 остаются низкими у женщин, прошедших КПТ, несмотря на повышение уровня ТТГ. Сопутствующее снижение уровня кортизола и повышение уровня ТТГ предполагает, что КПТ модулирует чувствительность гипоталамической обратной связи. Возможно, снижение уровня кортизола меняет чувствительность обратной связи таким образом, что гипоталамус начинает интерпретировать уровни Т3 и Т4 как слишком низкие, вследствие чего стимулируется синтез тиреотропин-рилизинг-гормона (ТРГ), который в свою очередь увеличивает выработку ТТГ [94]. Тиреоидная ось последней из гипоталамо-гипофизарных осей восстанавливается после стресса. Вероятно, для полной регенерации необходимо более длительная терапия или больший период наблюдения. В целом, когнитивный, нефармакологический подход, направленный на облегчение проблемных паттернов поведения, не только восстанавливает активность яичников, но и улучшает нейроэндокринную и метаболическую функции у женщин с ФГА.
ЗАКЛЮЧЕНИЕ
Функциональная гипоталамическая аменорея – это заболевание, нарушающее работу не только репродуктивной системы, но и других систем организма, что позволяет говорить о нем как о мультидисциплинарной проблеме. В большинстве случаев ФГА представлена вторичной обратимой аменореей, которая возникает, в основном, у подростков и молодых женщин. Несмотря на потенциальную обратимость, заболевание может вызвать серьезные последствия за счет глубоких изменений в различных системах организма, обусловленных длительной гипоэстрогенемией. Восстановление нормальных функций организма в таких условиях занимает много времени и не всегда приводит к желаемому результату.
Мультидисциплинарный подход, приверженность пациентки к лечению, а также наблюдение за ней на протяжении длительного времени – это ключ к сохранению здоровья и репродуктивного потенциала женщины с ФГА. Длительность заболевания и клинический портрет пациентки определяет индивидуальную тактику ведения каждой, модифицируя ее в соответствии с изменяющимися обстоятельствами и текущими жизненными планами женщины.

